细胞治疗在治疗某些恶性肿瘤方面取得了显著成效,如同向人体内引入了一支具有特殊装备的军队,特异性靶向杀伤肿瘤细胞。宜明生物创新性的自动化、全封闭Ubri Cure TM GMP 细胞治疗平台,可为 CAR-T细胞治疗产品提供工艺开发及放大、分析方法开发与质量研究、临床样品生产与放行、中美欧 IND 申报等一站式CDMO 服务模式。
依托全球的前瞻技术研发中心,宜明生物在细胞治疗药物开发领域建立了强大的技术储备池,始终与全球前沿市场的技术保持同步。丰富生产和工艺开发经验,符合NMPA, FDA和EMA等相关法规要求的cGMP厂房设计,已成功帮助客户完成18项IND项目获批进入临床,并成功交付百余批次临床级细胞产品生产订单。
100+批次临床级细胞产品制备
GMP质量管理体系,支持中美IND项目注册申报
专业的生产和检测团队,确保产品高质量交付
定制化方法学开发与验证服务,满足项目的个性化需求



宜明生物拥有专业的GMP质量控制团队,擅长方法学开发,可提供细胞治疗产品的质量控制方案。宜明生物的质量控制平台涵盖了化学、微生物学、生物化学等方面的检测,可提供多种技术解决方案,助力客户开发、建立细胞治疗产品的检测方法,满足所有GMP项目的检测要求。
| 检测项目 | 检测方法 |
| 性状 | |
| 目测 | |
| RetroNectin残留(ng/ml) | |
| ELISA | |
| 磁珠残留(个/3E+06 cells) | |
| 镜检 | |
| BSA残留(ng/ml) | |
| ELISA | |
| E1A基因转移 | |
| PCR | |
| SV40基因转移 | |
| PCR | |
| 活细胞密度(cells/ml) | |
| 细胞计数仪 | |
| 细胞活率 | |
| 细胞计数仪 | |
| T细胞分型CD3 | |
| 流式细胞仪 | |
| T细胞分型CD19 | |
| 流式细胞仪 | |
| CAR杀伤效率 | |
| 流式细胞仪 | |
| 细菌内毒素 | |
| 凝胶限度试验(凝胶法) | |
| 无菌检查 | |
| 直接接种法 | |
| 复制型病毒 | |
| PCR | |
| 支原体 | |
| qPCR | |
| pH值 | |
| pH计 | |
| 渗透压(mOsmol/kg) | |
| 渗透压仪 |
宜明生物组建了高效的项目管理团队,完善的项目沟通机制和全方面的IP保护,确保每一个CDMO项目的高质量实施交付。
项目管理团队
专业的项目管理团队
对客户需求及时响应
项目沟通机制
定期例会汇报项目进度
线上现场多渠道高效沟通
全方位IP保护
安全的信息加密系统
企业内部项目代码管理
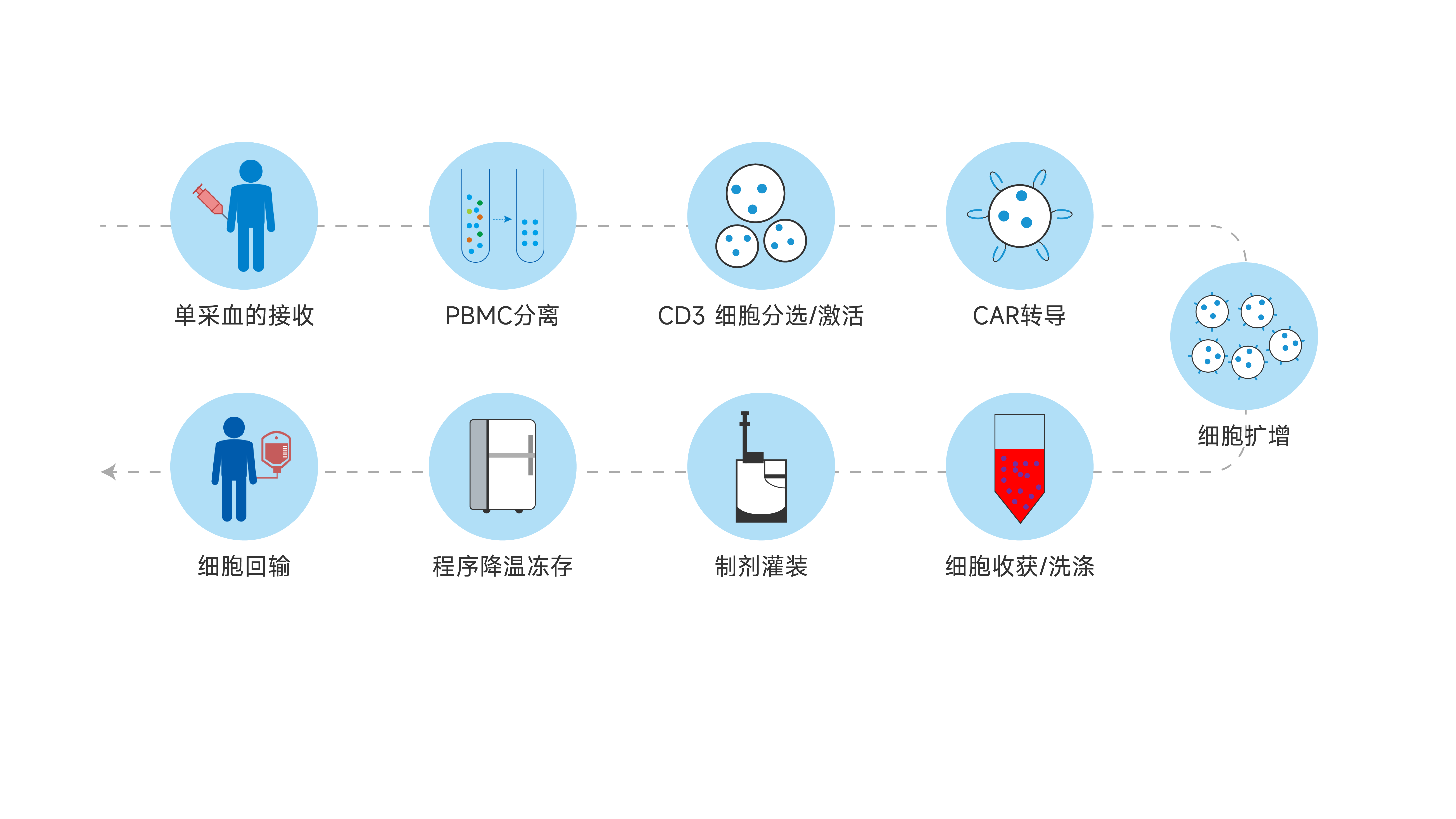
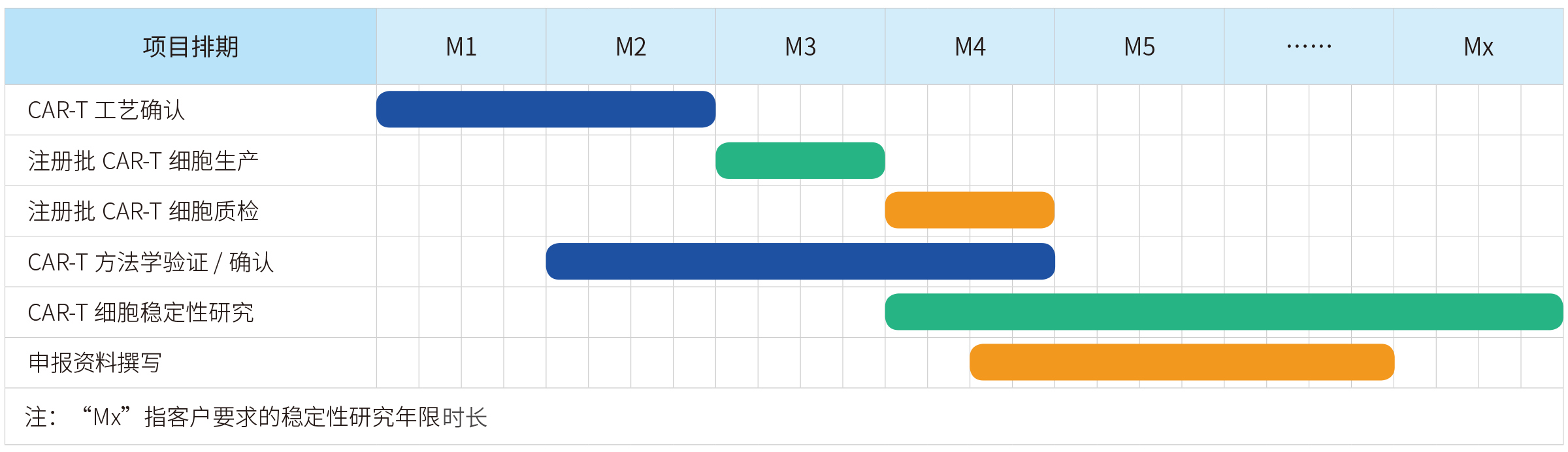
宜明生物建立了成熟的CAR-T细胞工艺平台,丰富的项目经验确保可以实现快速的开发生产流程,为客户提供完整的临床级IND项目服务,包括细胞库建库、工艺开发、方法学开发、稳定性研究,中试批生产等,亦可以根据项目需求提供定制服务。另外,为满足IND申报的要求,还可提供临床级CAR-T细胞批次生产记录、批检验记录以及相关验证资料等。
需要综合考虑这两个生产产地的关系,如是否完全独立,是否同属于一个集团?是否需要做非临床临床桥接试验,取决于药学是否可比。如果药学研究数据不足以确定可比性时,应进一步开展非临床和/或临床的桥接研究。
自体CAR-T原材料虽然是病人PBMC,但申报IND不需要国外PBMC,不需要工艺转移至国外基地,主要点是需要做PBMC和CAR-T产品的运输稳定性,以证明长途运输可以保证PBMC和CAR-T产品的稳定。
CAR-T的工艺主要包括分选、感染、扩增、细胞收获、加入冻存液、灌装、包装。一般以加入冻存液(辅料)之前划分为S,即CAR-T的S从细胞分选写到细胞收获。
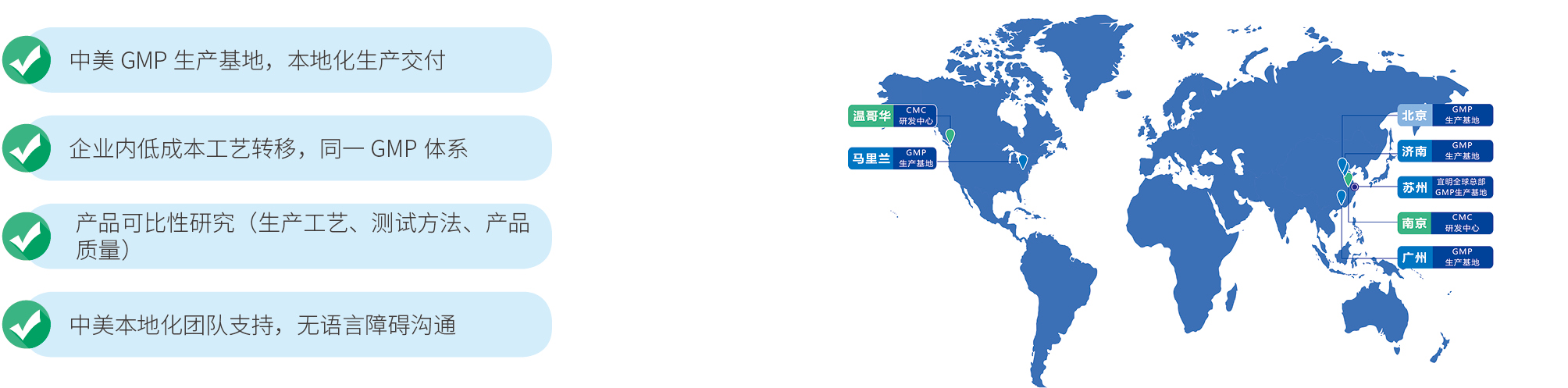
1)中美 GMP 生产基地,本地化生产交付
2)企业内低成本工艺转移,同一GMP 体系
3)产品可比性研究(生产工艺、测试方法、产品质量)
4)中美本地化团队支持

