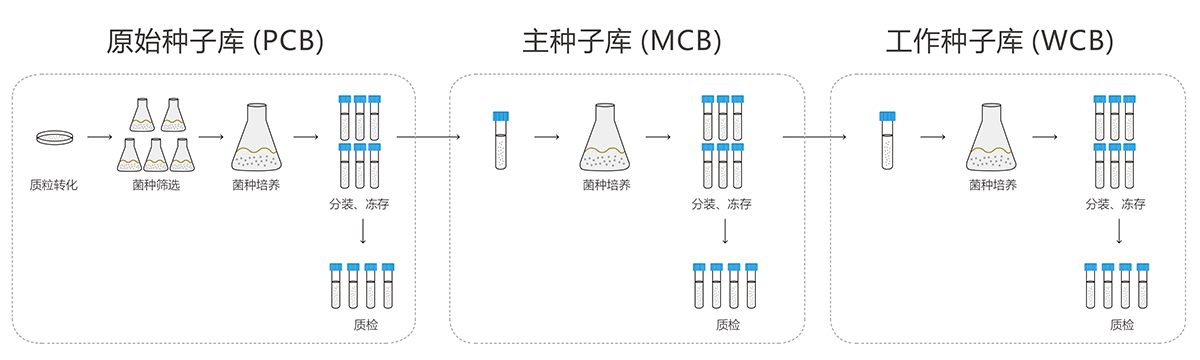
稳定良好的菌种库系统的建立是保证生产工艺一致性的至关重要的一环。宜明生物GMP厂房设有专门的原核细胞库构建车间和单独的储备车间,可提供原始种子库(PCB)、主种子库(MCB)和工作种子库(WCB)的构建以及储存服务,提供完整的符合现场核查的GMP资料。所有菌种库均按照NMPA及FDA要求进行鉴定验证,确保纯度和稳定性
依托全球的前瞻技术研发中心,宜明生物在细胞和基因药物开发领域建立了强大的技术储备池,始终与全球前沿市场的技术保持同步。丰富生产和工艺开发经验,符合NMPA, FDA和EMA等相关法规要求的cGMP厂房设计,已成功帮助全球客户完成18项IND项目获批进入临床,成功交付多个GMP级菌种库建库服务。
100+ 菌种库建库项目
GMP质量管理体系,支持中美IND项目注册申报
专业的生产和检测团队,确保产品高质量交付
定制化方法学开发与验证服务,满足项目的个性化需求
宜明生物拥有全面的稳定菌种库开发能力,成功用于客户项目并支持多个中美IND项目获批。
可追溯
菌株来源清晰
定制筛选
根据客户提供的DNA序列,筛选出稳定、高表达的单克隆菌株。
合规性
所有菌株严格按照药典要求进行验证鉴定,确保纯度和稳定性。
GMP级制备
三级菌种库均在符合GMP要求的车间进行制备。
安全储存
菌种储存的液氮罐均有液位及温度监控系统,实时报警功能。
依托完善的质量控制体系以及专业的GMP质量控制团队,宜明生物已建立完备的菌种库检测方法,满足所有GMP项目的检测要求,并可提供符合FDA要求的菌种检定和放行,确保满足国内外申报。 细胞库按照NMPA及FDA要求完成检定,部分检测项目以及方法如下:
| 检测项目 | 检验方法 |
| 菌落形态 | |
| 培养法 | |
| 革兰氏染色 | |
| 染色镜检 | |
| 生化反应 | |
| 培养法 | |
| 质粒限制性酶切图谱分析 | |
| 酶切 | |
| 质粒测序* | |
| Sanger 测序 | |
| 抗生素抗性检查 | |
| 培养法 | |
| 电镜检查 | |
| 电镜 | |
| 活菌数 | |
| 培养法 | |
| 质粒保有率 | |
| 培养法 | |
| 质粒拷贝数 | |
| QPCR | |
| 噬菌体 | |
| 噬斑法 | |
| 培养物纯度 | |
| 培养法 | |
| 16 SrDNA 序列检查* | |
| Sanger测序 |
宜明生物组建了高效的项目管理团队,完善的项目沟通机制和全方面的IP保护,确保每一个CDMO项目的高质量实施交付。
项目管理团队
专业的项目管理团队
对客户需求及时响应
项目沟通机制
定期例会汇报项目进度
线上现场多渠道高效沟通
全方位IP保护
安全的信息加密系统
企业内部项目代码管理
宜明生物建立了成熟的菌种库服务平台,丰富的项目经验确保可以实现快速的开发生产流程,为客户提供完整的临床级IND项目服务,包括细胞库建库、工艺开发、方法学开发、稳定性研究等,亦可以根据项目需求提供定制服务。

1)转化、筛选适合规模放大的优势菌种并建立PCB
2)分别建立MCB和WCB,每一级库的可提供的不超过500支,实际数量可根据需求进行调整
3)WCB传代稳定性研究
4)质检
一般菌种库是做CICC的电镜检查,是确认菌种及是否有杂菌污染,同时我们菌种库也做镜检,是检测革兰氏染色,确认菌种是革兰氏阴性还是阳性菌。但注意,一般是不会包括对含有转录模板质粒的菌株中的模板质粒上的PolyA的长短的质控。
菌种库检测项目可参考中国药典2020版本,三部治疗类产品检测内容以及《体外基因修饰系统药学研究与评价技术指导原则(试行)》以及药典三部治疗类产品检测项目要求等法规。中美双报对菌种库检测项目有差异,可参考相关规定与指导原则。
宜明生物一般情况使用的是 YM5ɑ,溯源清晰,并且已经MCB及WCB,拥有完善的相关溯源性资料,可以支持IND申报。如果客户需用stable3,宜明也可以提供;以宜明的经验和技术,根据几十种不同质粒的开发生产经验,使用YM5α,不会存在基因突变问题,目前几个拿到IND批件的客户,使用的也是YM5α。

