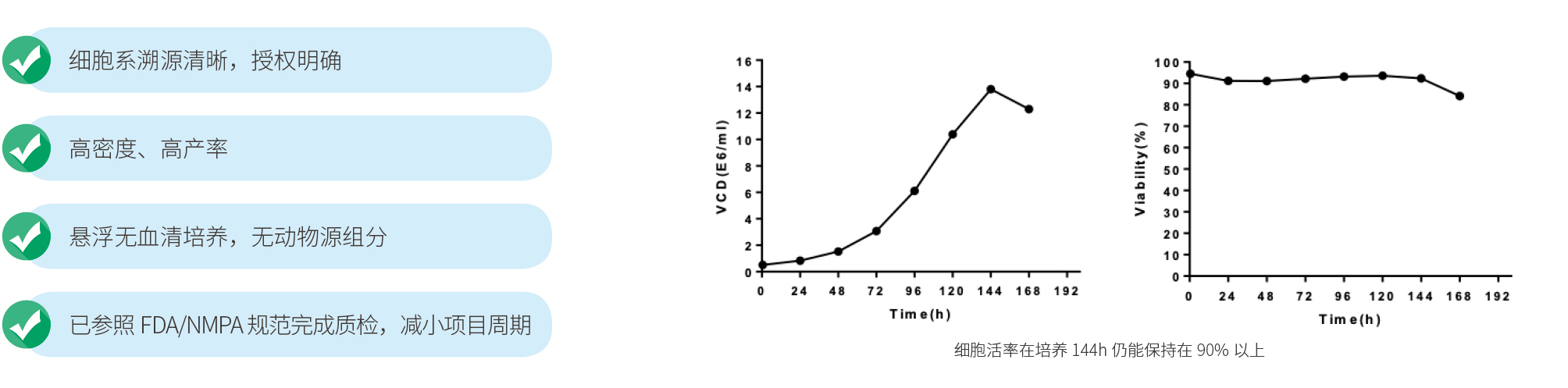
稳定良好的细胞库系统是保证生产工艺一致性的重要一环。宜明生物GMP厂房设有专门的真核细胞库构建和储备车间,可提供原始细胞库(PCB)、主细胞库(MCB)和工作细胞库(WCB)构建以及储存服务。宜明生物专有的悬浮293XS和贴壁293T、悬浮293TH细胞株适用于AAV和慢病毒的规模化工业生产。所有细胞库均按照NMPA及FDA要求进行鉴定验证,确保纯度和稳定性。


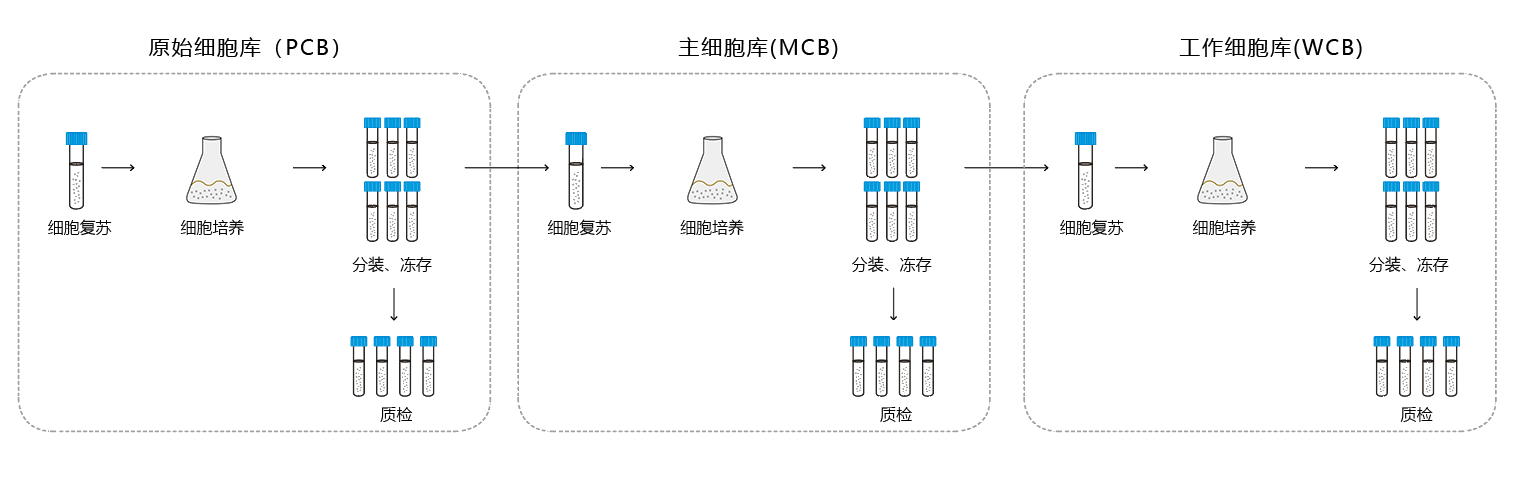
依托完善的质量控制体系以及专业的GMP质量控制团队,宜明生物已建立完备的细胞库检测方法,满足所有GMP项目的检测要求,并可提供符合FDA要求的菌种检定和放行,确保满足国内外申报。 所有细胞库均按照NMPA及FDA要求完成检定,部分检测项目以及方法如下:
| 检测项目 | 检验方法 | |
| 细胞活率 | ||
| 自动细胞计数仪计数法 | ||
| 细胞密度 | ||
| 自动细胞计数仪计数法 | ||
| 无菌检查(USP) | ||
| 直接接种法 | ||
| 无菌检查(CHP) | ||
| 直接接种法 | ||
| 支原体检查(USP) | ||
| 培养法 | ||
| 支原体检查(USP) | ||
| 指示细胞法 | ||
| 支原体检查(CHP) | ||
| 培养法 | ||
| 支原体检查(CHP) | ||
| 指示细胞法 | ||
| 人源病毒因子检测(ChP/USP) | ||
| qPCR法 |
宜明生物组建了高效的项目管理团队,完善的项目沟通机制和全方面的IP保护,确保每一个CDMO项目的高质量实施交付。
项目管理团队
专业的项目管理团队
对客户需求及时响应
项目沟通机制
定期例会汇报项目进度
线上现场多渠道高效沟通
全方位IP保护
安全的信息加密系统
企业内部项目代码管理
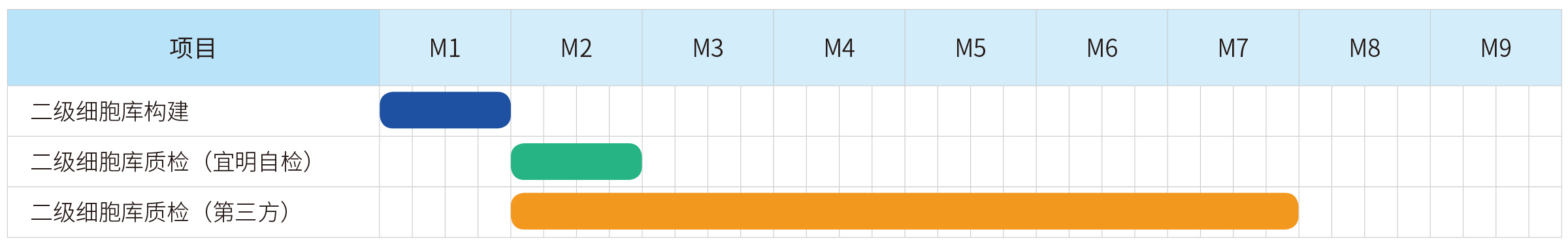
宜明生物建立了成熟的细胞库服务平台,丰富的项目经验确保可以实现快速的开发生产流程,为客户提供完整的临床级IND项目服务,包括细胞库建库、工艺开发、方法学开发、稳定性研究等,亦可以根据项目需求提供定制服务。
宜明使用的293XS细胞是宜明自主驯化改造的,目前已经申请专利,专利在受理中,具有自主知识产权,后续可以做专利授权。
按照法规要求,建立二级细胞库之后需要对MCB及WCB进行检测,中国申报可以送到中检院进行检测,,国外申报建议送到bioreliance进行检测。
需要的,需要做冻融复苏、传代稳定性等稳定性研究。
大致列举如下,无菌:菌种来源、种类;支原体:中国无阳性对照,FDA要求使用至少2种阳性对照;培养基组分不一致。中国要求检分枝杆菌,FDA无要求;细胞形态和血吸附,中国要求。动物体内接种法:鸡胚、鼠接种途径不一致。USP要求第一轮存活动物的组织匀浆接种第二轮。牛源病毒:病毒种类不一致。培养条件与chp不完全一致。猪源病毒:种类不一致。国内可以用PCR法,FDA用培养法观察细胞病变和血吸附。猴源病毒种类不一致。均可用PCR法。

