
近日,宜明生物位于美国马里兰的细胞与基因治疗(CGT)GMP生产厂房完成美国FDA的DMF(Durg Master Files, 药品主文件)备案,并收到确认函,备案号为MF 32166。此举是宜明生物在构建国际化合规体系和强化全球供应链能力进程中的一项关键突破。

随着越来越多的中国创新药企面向全球开展临床试验、推进注册申报,DMF备案已经成为中国创新药“走出去”的关键战略通路:
药企可直接引用DMF备案号,大幅减少其在 CMC模块中的撰写压力与审核风险。
DMF备案提供独立、权威、完整的工厂与工艺质量数据,让药监机构对生产体系更有信心,从而加速新药的跨国试验与上市进程。
合作方只需授权引用DMF备案号,即可满足监管要求,节省时间与资源投入。
宜明生物目前已完成多项FDA DMF备案,覆盖关键原材料、生产基地及质量控制体系,构建了完善的DMF备案库,为国内CGT企业提供一条更高效可靠的国际化“快车道”。
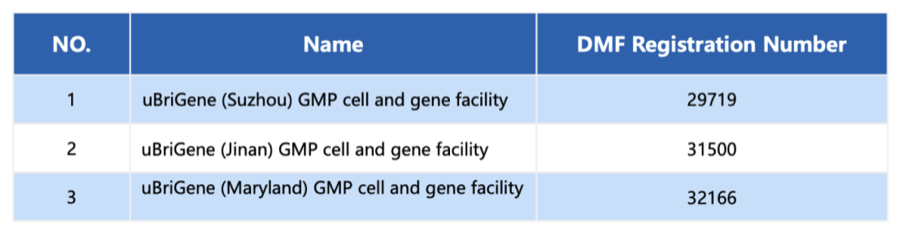
随着中国苏州、济南及美国马里兰GMP生产基地相继完成备案,宜明生物在中美两地的关键生产厂房均已获得DMF备案,为其全球化布局奠定了坚实的合规基础。这意味着,宜明生物的客户在进行中美双报时,可直接引用相关DMF编号,从而大幅简化申报材料、加快审评进程,为全球细胞与基因治疗药物的开发提速。
表:宜明生物的中美关键生产基地均完成DMF备案
宜明生物深耕CGT领域十余年,已构建四大GMP生产平台,形成覆盖药物发现至商业化生产的完整服务体系,具备批量化、自动化、规模化的全流程服务能力。
更高效地承接全球CGT项目的CDMO生产
为国际客户提供更高等级的合规背书
支持更多中国企业的产品加速进入海外市场
GMP厂房DMF备案的完成,不仅是公司技术与质量体系的重大里程碑,更是宜明生物迈向全球先进治疗产业链核心节点的重要一步。未来我们将以更高标准、更强能力与更开放的合作姿态,与全球伙伴共同推动细胞与基因治疗产业的发展,为全球患者带来更多治疗新希望。
关于宜明生物
宜明(北京)生物医药有限公司(简称“宜明生物”)成立于 2015 年,是一家致力于先进治疗药品(ATMP) 的技术开发和应用,提供一站式 CRDMO 整体解决方案的全球化企业。宜明生物在美国马里兰,中国北京、苏州、济南和广州建立GMP 生产基地,总面积超30,000平米,配备50+条生产线,涵盖质粒、病毒载体、细胞治疗药物及 RNA 药物临床及商业化生产,并在温哥华、南京设立了专注于前瞻性技术开发应用的全球研发中心。已承接/交付临床级产品(IIT/IND/I-II期)百余批次,帮助客户完成数十项创新药物IND获批临床。宜明生物依托国际化的专家团队及全球化布局的研发与生产基地,打造符合国际标准的CRDMO平台,为全球ATMP企业提供从早期研发、工艺开发、临床研究(IIT/IND/I-III期)到商业化生产的一站式解决方案。


