简述环状RNA的特征与应用前景(一)
2019年冠状病毒大流行极大地推动了mRNA疫苗领域的发展和进步,人们不仅注意到mRNA技术在未来疫苗开发领域的颠覆性潜力,同时也引发了对RNA疗法用于治疗其他传染病、肿瘤等疾病的热情。但是mRNA的不稳定性和免疫原性阻碍了其广泛应用。
与线性RNA相比,环状RNA(circRNA)缺乏5′帽和poly(A)尾,是一种独特的共价封闭的单链RNA分子,对RNA酶抑制剂(rnasin inhibitor, RNAse R)具有高度抗性,可稳定存在于细胞或组织中。另外circRNA具有物种特异性,在不同的组织和细胞中具有特异性的表达谱。因此以上诸多优势使circRNA成为生物医药领域炙手可热的“顶流”分子。到目前为止,人们已经尝试应用合成的circRNAs替代治疗性蛋白质、多肽以及疫苗,还将其用作生物传感器。
我们将陆续就circRNA的特征、应用前景,以及工业生产等多面进行简单的介绍。
circRNA的特征
1、稳定性
与线性RNA相比,circRNA的主要优势在于其环形结构增加了稳定性。细胞内大多数线性mRNA的降解主要依赖于脱腺苷酸的降解方式(图1)。线性mRNA 的 3'-端通常带有 poly(A)尾, 脱腺苷酸化作用是大多数 mRNA 进行降解的第一步, 由多种脱腺苷酸化酶催化 。脱腺苷酸化后的 mRNA 可脱去 5' 端帽子结构,再由 5' 端到 3' 端进行降解。circRNA缺少5’和3’末端,因此与线性mRNA相比,具有外核酶抗性和更高的体内稳定性。
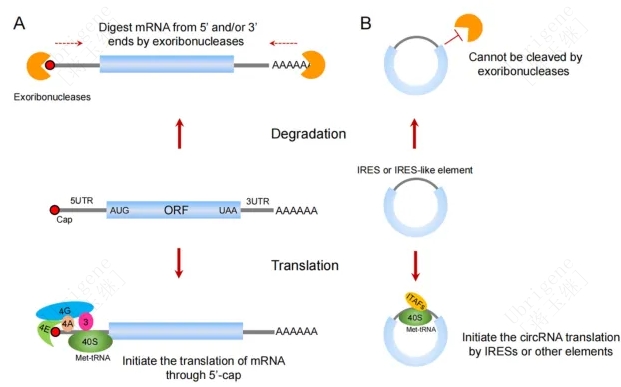
图1|环状rna和线性mrna的比较。A) mRNA包含一个5 ' -cap和3 ' -poly (A) 尾。它可以通过帽依赖翻译进行翻译。大多数mRNA被5 '和/或3 '端外切酶降解。B) CircRNA缺少5 '和3 '端,可以抵抗外切酶的降解,并且可以以帽独立的方式翻译。(Doi.org/10.1093/jmcb/mjad031)
虽然circRNA不能通过经典的RNA降解途径降解,但内切酶可以使其线性化并导致降解。而且circRNA的序列、结构的复杂性,修饰以及环境的影响都会影响其衰变机制,见图二。
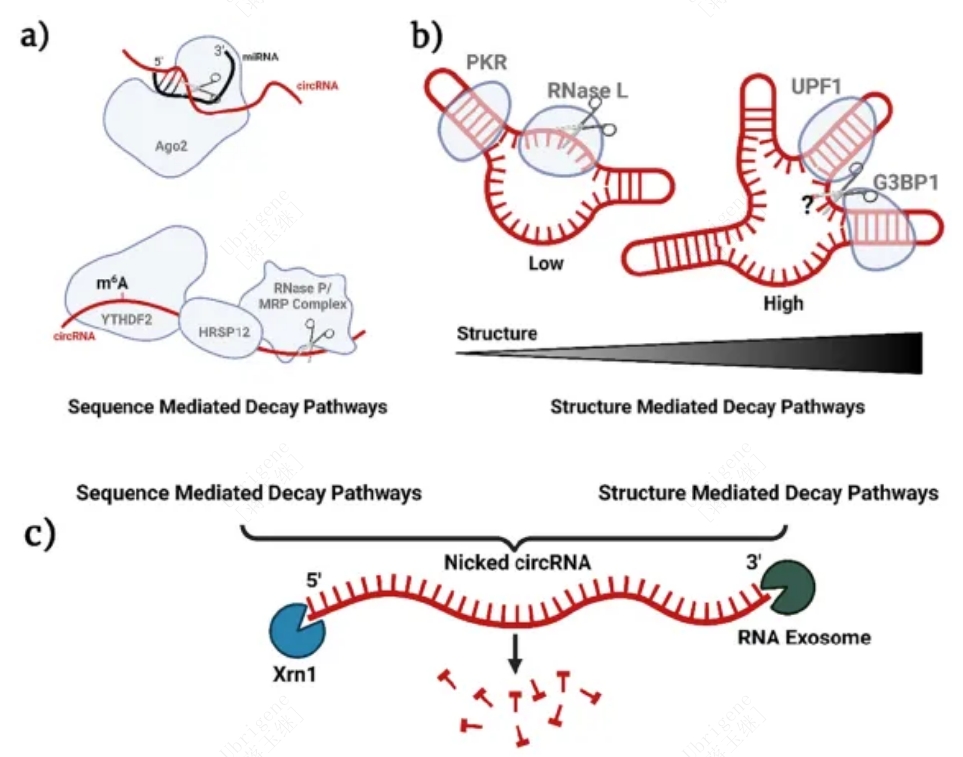
图2|已知的circRNA的降解机制举例。(a)细胞质circRNA通过识别序列的降解方式。上图:miRNA引导的circRNA降解。下图:m6A介导的circRNA降解。(b)细胞质circRNA通过识别结构复杂性的降解方式。左图:PKR识别dsRNA并激活RNaseL介导的circRNA降解。右图:RNA结合蛋白UPF1及其相关蛋白G3BP1介导高度结构化circRNA的降解。(c)一旦有缺口,典型通路会降解线性化的circRNA。(Doi.org/10.1016/j.addr.2023.114826)
尽管,除了这些途径外,circRNA降解的整体机制和调控仍未被全面表征,但circRNA更好的稳定性使其能在更长的时间内发挥作用。
表1|circRNA与基于病毒载体、线性RNA、DNA的治疗相比,其免疫原性更低,更安全(Doi.org/10.1093/jmcb/mjad031)

2、非规范翻译启动机制
在真核生物中,线性mRNAs采用5 '帽依赖的翻译方式(图1)。这一翻译启动机制所需起始因子和步骤数量多,需要消耗大量能量。因此,在细胞应激等的不利条件下,这一规范翻译机制被“关闭”以确保细胞在应激反应中存活。在帽依赖性翻译失活过程中,细胞则依赖非规范机制来产生生存所需的关键蛋白。
2017年,人们发现缺乏5 '帽结构的circRNA采用5 '帽独立的翻译机制,也可以编码蛋白。该机制或依赖于IRES,或依赖于m6A RNA修饰,其中IRESs是最具代表性的帽独立翻译起始机制(图1、图2)。5’UTR元件形成二级和三级结构,或在IRES反式作用因子(IRES transacting factors ,ITAFs)的帮助下直接招募核糖体亚基,从而绕过了帽识别和eIF4F复合物的需要。
简言之,circRNA在病毒感染或疾病相关应激中仍然可以编码蛋白,因此,circRNA比采用帽依赖的线性mRNA疗法更具有潜在优势。
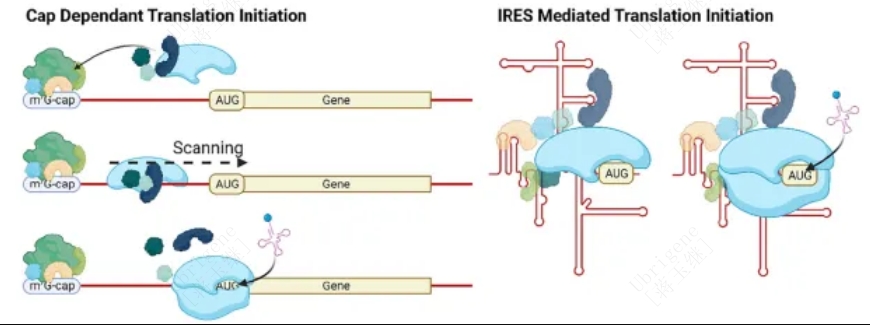
图2|左:帽依赖的翻译起始。eIF4F识别mRNA的5’帽结构,招募43S预起始复合物,随后在AUG起始密码子上进行40S和60S核糖体亚基组装。右:IRES介导的帽独立翻译起始。IRES直接招募40S核糖体亚基来启动80S核糖体在近端起始密码子的组装,而不需要规范的起始因子或5’帽。(Doi.org/10.1016/j.addr.2023.114826)
3、蛋白表达
◆ 滚动圈扩增/翻译
翻译起始是蛋白表达的限速步骤 (见图2)。对于线性mRNA来说,核糖体必须反复与RNA模板结合以持续产生编码的蛋白质。然而,circRNA的结构允许单个起始事件通过滚动圈扩增/翻译(rolling circle amplification/translation,RCA/RCT) 重复翻译相同序列。如果从阅读框中去除所有终止密码子,就可能生成无限开放阅读框(ORF)。有人构建了一种含有无限阅读框的 circRNA,发现其能模拟 RCA 在大肠杆菌内进行翻译, 且产物分子量约是其同源线性 mRNA 的 100 倍。重要的是,该产物将是一个大的,串联的产物,可以使用间隔的裂解位点将其分离成不同的单位。
◆ 多顺反子表达
真核生物中常见的是单顺反子表达机制,即“一基因一多肽”。而原核基因组、病毒基因组和线粒体DNA中多是多顺反子表达,即一个mRNA分子可以编码多个蛋白分子。如果在circRNA导入多个IRES-ORFs,有可能达到接近化学计量的多顺反子表达,因为所有编码的蛋白都具有相同的翻译起始机制。circRNA的多顺反子表达可能对多组分蛋白的纯化有益,并有可能控制蛋白质复合物组分的比例。
4、免疫原性
虽然工程化circRNAs的免疫原性一直存在争议(后续文章将详细讨论),但肯定的是,circRNA比mRNA具有更低的免疫原性。
线性RNA通过病原体识别受体刺激先天免疫系统,引发干扰素翻译并抑制线性RNA的治疗作用;免疫刺激还可引发针对编码产物不必要的免疫反应,从而抑制其功效。修饰的mRNA(如N1--甲基伪尿嘧啶)可以帮助RNA逃避免疫传感器,如RIG-I和toll样受体(TLRs),从而使mRNA药物成为可能。因此获得高纯度或修饰是限制免疫原性的关键,有助于免于免疫刺激,可以更好地发挥RNA药物的疗效。
较之线性RNA,“免疫沉默”的 circRNA可以更有效地表达蛋白质,而不会产生抑制性干扰素反应。此外,先天免疫系统激活的降低限制了树突状细胞的激活和成熟,从而有助于逃避对所编码的治疗性蛋白的免疫。纯化的circRNA也不具备三磷酸基序以及ssRNA或dsRNA片段。
Ref:
1.Clinical delivery of circular RNA: Lessons learned from RNA drug development ,Doi.org/10.1016/j.addr.2023.114826
2.Differences in the immunogenicity of engineered circular RNAs ,Doi:10.1093/jmcb/mjad002
3.RNA-based therapeutics: an overview and prospectus, Doi.org/10.1038/s41419-022-05075-2
4.Biological functions and applications of circRNA-next generation of RNA-based therapy ,Doi.org/10.1093/jmcb/mjad031
5.环状RNA在病毒感染性疾病中的作用机制,DOI: 10.3760/cma.j.cn114452-20191225-00754
6.Translatomics: methods and applications,Doi: 10.1348/j.smhx.20170111

