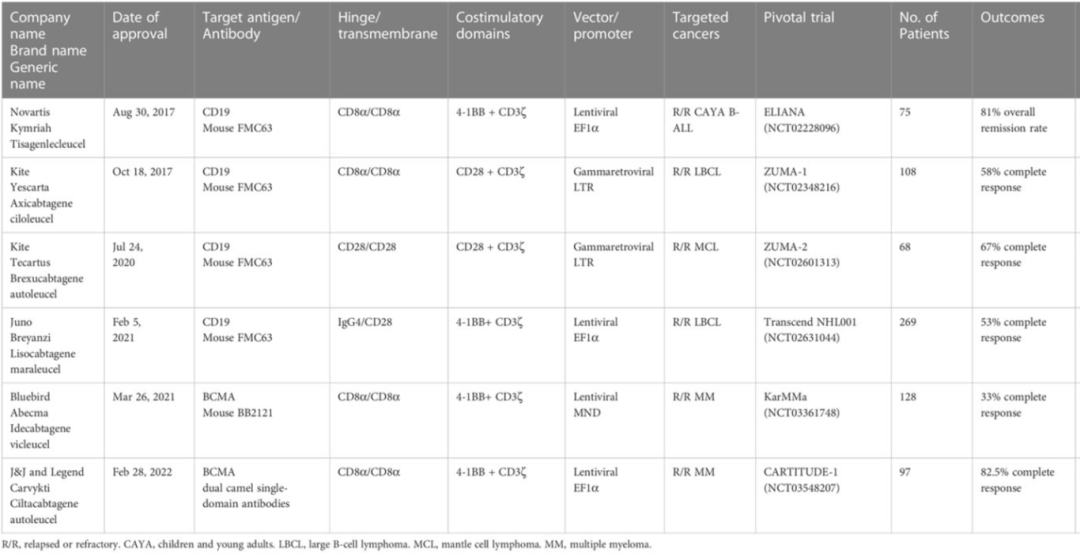
3月1日,国家药品监督管理局批准了科济药业的CAR-T细胞疗法泽沃基奥仑赛注射液的新药上市申请,用于治疗复发或难治性多发性骨髓瘤成人患者。截至发稿前,已有11款CAR-T疗法获批上市(其中经NMPA批准在国内上市有5款、经FDA批准上市有6款)(表一&图三)。近期宜小明将陆续推出关于CAR-T细胞疗法技术的系列文章,敬请关注。
表一:FDA批准上市6款CAR-T疗法以及各自的CAR结构(doi.org/10.3389/fimmu.2023.1188049)
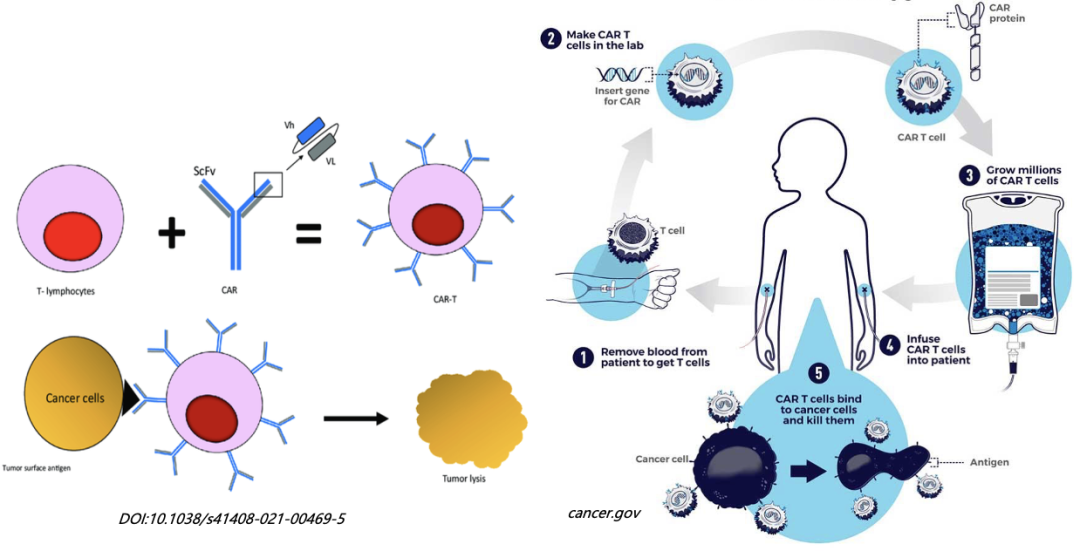
嵌合抗原受体(Chimeric antigen receptor ,CAR)T细胞治疗是过继T细胞免疫治疗(adoptive T-cell immunotherapy ACT)的一种形式,通过改造患者自身的T淋巴细胞来增强其识别和杀死癌细胞的能力,具有靶向性强、治疗效果持久、副作用小等优势,在临床前以及临床试验中疗效显著,已成为肿瘤治疗历史上里程碑式的成就。
CAR-T治疗一般先从肿瘤病人血液中分离纯化T细胞;用基因工程技术,把一个含有能识别肿瘤细胞且激活T细胞的CAR的载体转入T细胞,即把T细胞改造成CAR-T细胞;体外扩增CAR-T细胞;将CAR-T细胞回输入患者体内用于治疗(见图一)。
关于“CAR”
CAR-T,简言之就是 “CAR ”+“T 细胞”的组合。CAR是一种合成的免疫受体,可以将单克隆抗体衍生的单链可变片段(scFv)连接到T细胞信号域。T细胞一旦“武装”了CAR,就成为“活”药物,无需依赖MHC识别,即可消除目标肿瘤细胞。
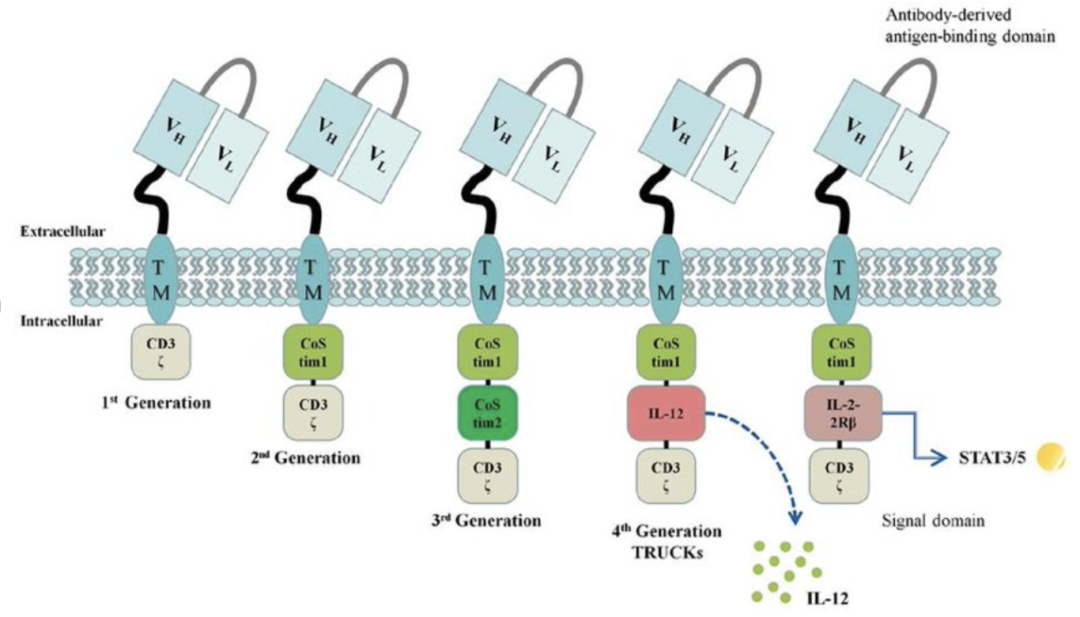
CAR的基本设计可分为以下三个区域:1)胞外抗体衍生抗原结合域,用于抗原识别结合,通常含有来自抗体的单链可变片段;2)跨膜结构域用于锚定支撑质膜;3)胞内 T细胞激活信号域。根据“共刺激分子序列”结构的不同,CAR-T 细胞可分以下五代(见图三):
第一代CAR-T诱导T细胞激活仅通过CD3ζ信号域激活,缺少共刺激信号,细胞活性和效力很弱,需要外源性给予细胞因子
第二代CAR-T中增加了一个4-1BB、或CD28、或OX40分子共刺激结构域,增强来自TCR-CD3的信号,细胞增殖能力和杀伤毒性都大大的增加
第三代CAR-T增加了两个或更多共刺激结构域,包括CD28、4-1BB (CD137)、CD27和OX40 (CD134)。但是第三代的临床表现并不优于第二代CAR-T
第四代CAR-T也被称为TRUCK,在二代的基础上可以诱导表达IL-12等趋化因子,克服了肿瘤免疫微环境的抑制,通过修饰肿瘤微环境募集并活化其他免疫细胞进行免疫反应,进一步增强对肿瘤的杀伤作用
第五代CAR-T包括一个新的共刺激域来激活一些特定的信号通路
目前FDA批准的6款产品属于第二代CAR结构。
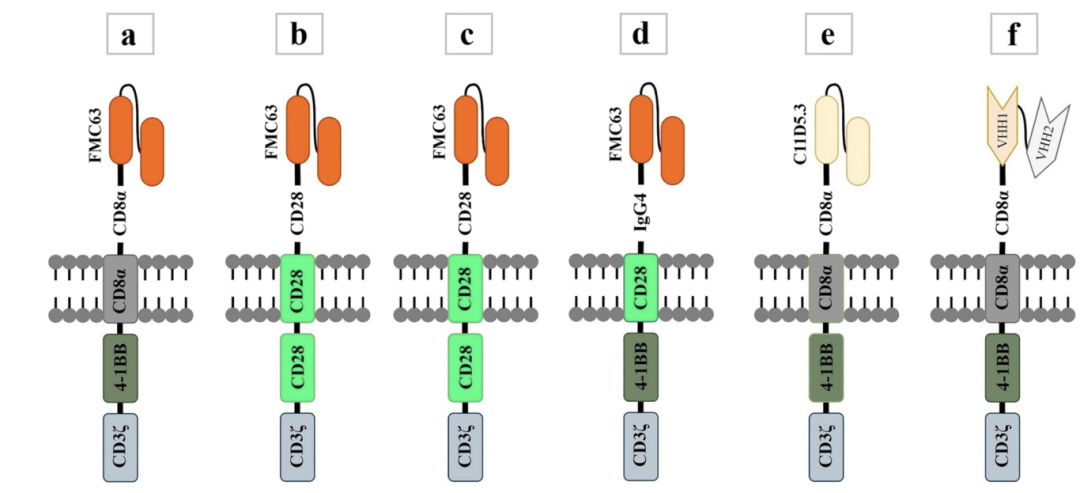
图三:6款FDA批准的CAR-T 产品CAR构建模式图。Tisagenlecleucel (a), Axicabtagene ciloleucel (b), Brexucabtagene autoleucel (c), Lisocabtagene maraleucel (d), Idecabtagene vicleucel (e), Ciltacabtagene autoleucel (f) (doi.org/10.1186/s40364-022-00417-w)
用于CAR基因转导的慢病毒载体系统
如何将CAR 基因导入T 细胞呢?怎样的载体才是理想化的呢?这是CAR-T细胞制备的关键环节。
理想的载体应该具有转染效率高、稳定性好,免疫原性低等特点。目前用到的载体包括非病毒载体 (转座子转染、电穿孔等技术等)和病毒载体。病毒载体中应用的比较广泛的是γ-retroviral vector(gRV)和Letiviral vector(LV)。但与慢病毒载体相比,γ-逆转录病毒转导致癌风险较高、病毒滴度较低且不能感染非分裂细胞。本文主要介绍慢病毒载体。
目前应用的LV载体大多来源于逆转录病毒科的人类免疫缺陷病毒1型(HIV-1)。经过修饰改造的LVs 可以携带长达10kb的外源基因片段,并稳定地整合到宿主基因组中。
LV基因组编码三个结构基因,分别是gag、pol和env。其中gag序列编码病毒的内膜蛋白、衣壳蛋白和核衣壳蛋白。pol序列编码病毒复制所必需的酶。env序列编码包膜蛋白,包括gp120 和gp41。gp120 /gp41异源二聚体与靶受体相互作用,可定义病毒的靶向性。此外,HIV基因组还编码调控元件Tat和Rev以及辅助蛋白Nef、Vpr、Vif和Vpu。HIV的复制需要调控元件,但辅助蛋白则可增强病毒复制并与体内致病性相关。HIV基因组的两侧是两个长末端重复序列(LTR),这对于病毒基因组的表达以及整合到宿主细胞基因组至关重要。
人们通过将逆转录病毒基因组的成分组合到重组质粒DNA 中,开发出并逐渐完善了慢病毒载体系统(见图四)。该系统旨在增加载体的有效载荷,抑制病毒复制,并在保留功能的同时限制病毒的致病性。
第一代两质粒系统,与野生型病毒基因组最相似。该系统以HIV-1为骨架,去除其中的反式作用蛋白基因序列。这是一个复制缺陷型的载体体系,产生的病毒滴度很低,而且只能感染CD4+细胞,而且在转染的过程中有产生活性HIV病毒的风险。
第二代三质粒系统,将HIV-1基因组中负责包装,逆转录和整合所需要的顺式作用序列结构和编码反式作用蛋白的序列分离,分别克隆到三个独立的质粒中,并去除了辅助蛋白Nef、Vpr、Vif和Vpu。这些辅助蛋白对于病毒功能并非必须,而且与致病性、疾病进展与在人类中的传播有关。
第三代四质粒系统在第二代的基础上1)将rev基因放在一个单独的表达质粒上;2)去除tat基因;3)修改了转移质粒的5 ' HIV LTR序列,并应用了强病毒启动子(如CMV或RSV启动子)。四个质粒的系统,即pGag/Pol、pRev、pVSV-G,是目前CAR-T细胞疗法最常应用的系统。

图四:三代慢病毒载体系统的变迁(doi: 10.3390/v13081528

