自20世纪60年代以来,基因治疗领域几经起落,现已成为继小分子和抗体药物之后的最受关注的生物科技领域之一。目前,基因疗法主要采用病毒载体递送系统,其中腺相关病毒(adeno-associated virus, AAV)因其高效、安全、靶向性强等优势备受青睐,约三分之一的基因治疗临床试验选择使用的是AAV载体。
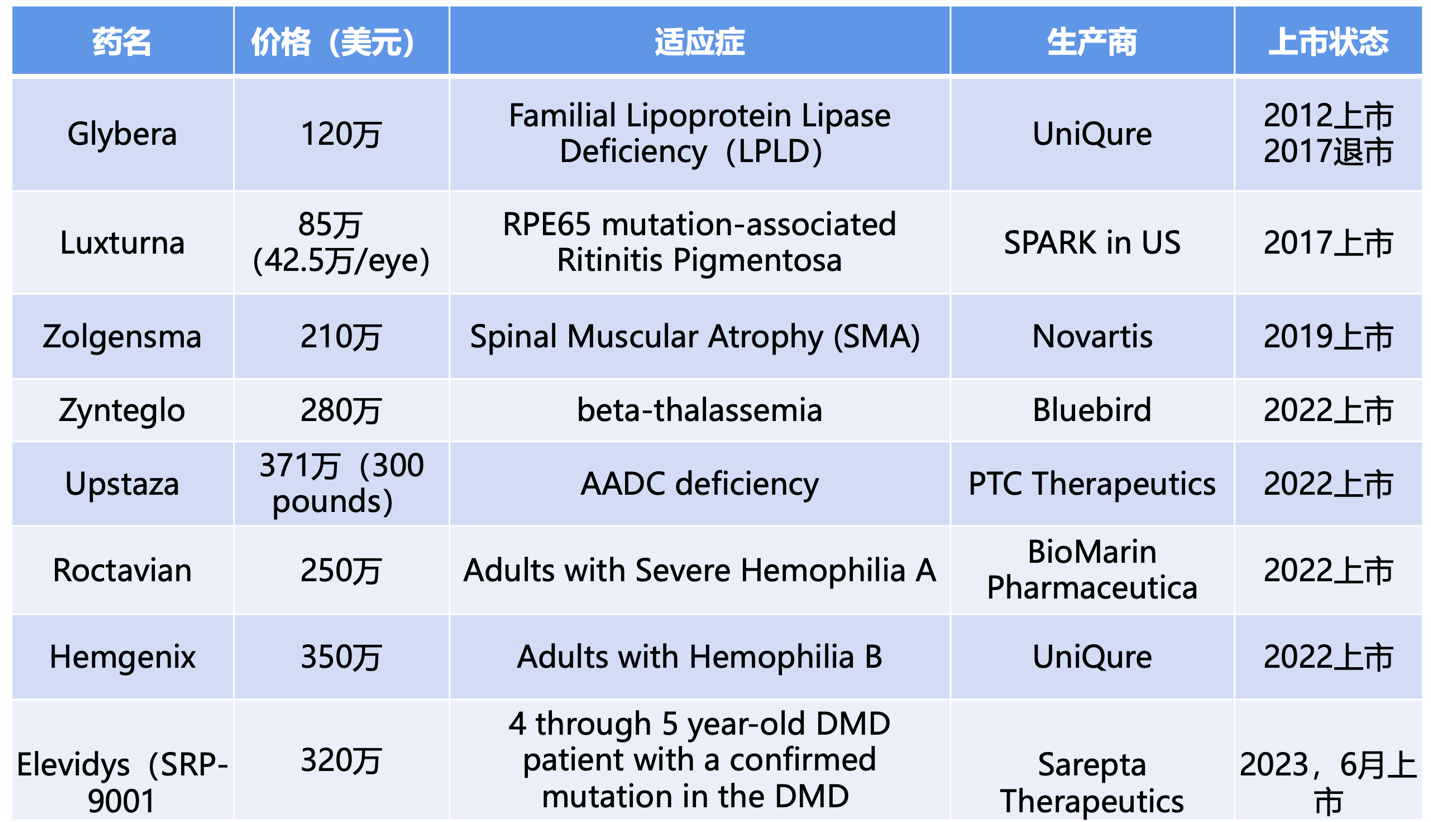
随着AAV生产工艺研发的不断推进,商业化的不断加强、监管的逐渐完善以及对该领域投资的日益增加,AAV基因治疗领域取得了巨大的进步。人们已经将对其治疗潜力的展望转向了对这类疗法商业化的期盼。截至发稿前,FDA业已批准8款AAV基因疗法上市(表1)。国内AAV基因治疗领域也在加速崛起,据不完全统计,截至2024年3月已经有近40款AAV基因治疗药物IND申报获批,其中至少3款进入III期临床(包括纽福斯的NR082、信念医药的BBM-H901、诺华的OAV101)。中国的AAV基因疗法也即将进入商业化的时代。
表1:获FDA批准上市的8款AAV基因疗法(宜明生物整理)
随着AAV基因疗法的不断“破圈”,从罕见病领域到更多、更常见以及更复杂的适应症,意味着需要提供更高的产量以及更低的成本的病毒载体以满足市场需求。但目前宿主细胞AAV生产率低,生产工艺放大壁垒高,以及生产过程中出现的高水平杂质(如空壳率等)直接影响了基因治疗药物的商业化进程。此外,AAV免疫原性和宿主免疫反应、AAV药物本身表征的难度、 各地区监管机构的差异等也阻碍了这些创新疗法向临床应用转化。本文将探讨AAV在生产工艺等多个环节面临的种种挑战,以及可能的解决方案。
如何突破生产工艺的层层技术壁垒
病毒载体生产工艺改进的最终目标是实现上游更高的病毒滴度和下游更高的回收率以及更高效和可扩展的制造平台,从而提高病毒载体生产效率,降低产品成本,摆脱基因药物“天价药”的标签。
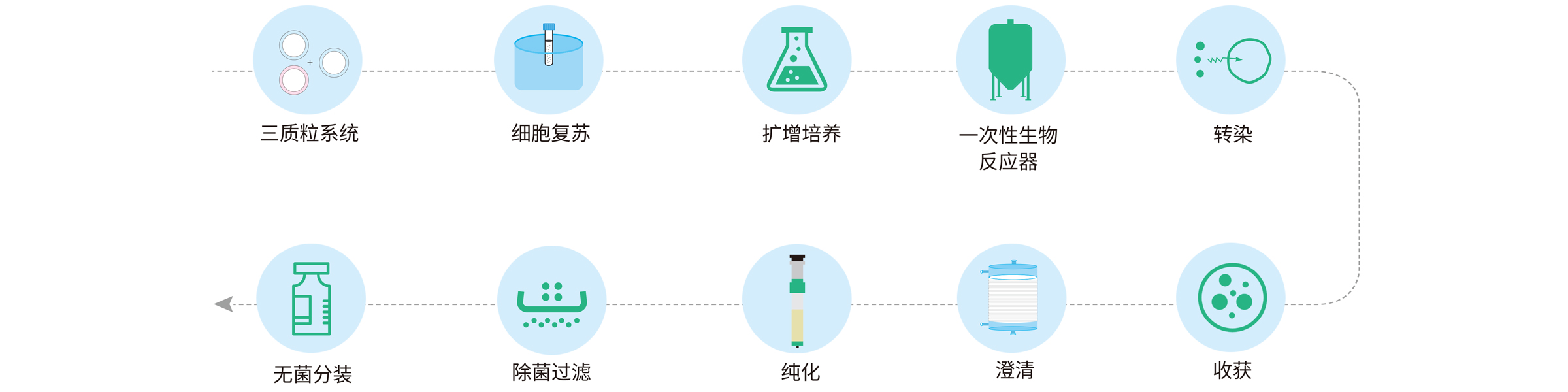
图1:AAV的工业生产流程(图片来自宜明生物)
上游生产环节的挑战
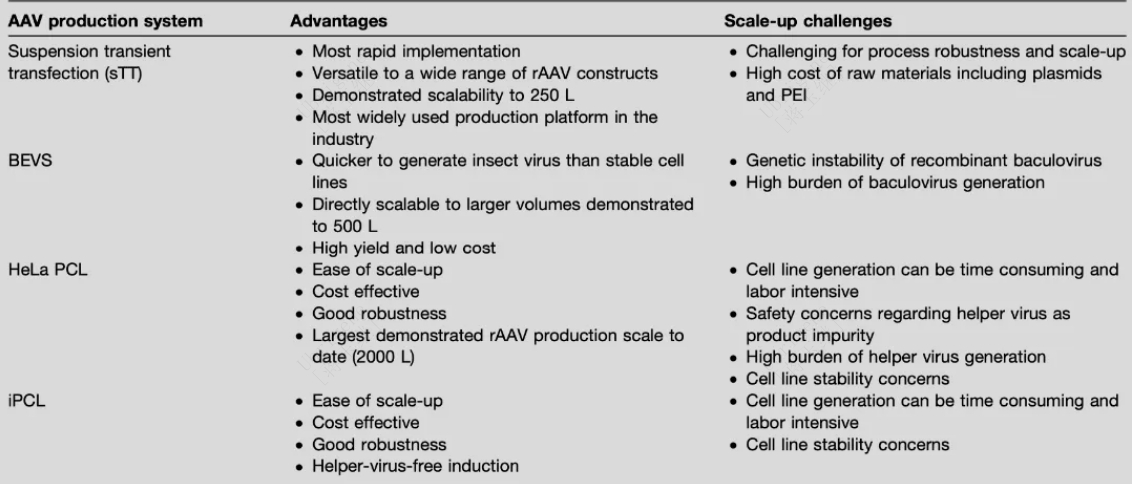
在上游生产中,AAV生产细胞平台的选择是解决产量问题的关键。AAV生产平台主要有三种:三质粒瞬转体系(Transient Transfection, TT)、杆状病毒表达载体体系(Baculovirus expression vector, BEV)和稳定包装细胞系(Packaging/Producer cell line, PCL)。目前,绝大多数基于AAV的基因疗法生产仍然使用三质粒瞬转体系。
表2:AAV几大生产平台优势与挑战
1、在三质粒瞬转体系(TT)中,粘附培养方式(Adherent TT,aTT)尽管周期短,生产灵活,但是难以放大;而悬浮培养方式不仅具有可放大性,还可实现无血清培养,排除血清中未知组分以及外源因子的污染,更符合监管要求,是AAV大规模生产主要采用的方式。
然而三质粒瞬转体系转染过程复杂,除了受传统细胞培养工艺参数(如温度、pH、搅拌速度)影响外,其他转染工艺参数,如转染试剂与DNA的比例、质粒数量、质量以及不同质粒的比例、孵育时间、转染时细胞密度等等都可能影响转染效率与转染后细胞健康情况。此外,哺乳动物细胞生产AAV能力有限可能导致其生产的病毒滴度低的根本原因。而AAV包装效率低则是另一瓶颈,研究表明只有20%-30%的复制转基因被衣壳包装。因此,人们一直在寻求可替代TT的方法,以更有效和可扩展的AAV生产方式。
在宜明生物,我们一直致力于通过技术创新来突破层层壁垒。
宜明生物Ubri-AdvancedTMGMP级AAV生产平台是一个具成本效益和可扩展性的病毒载体制造平台,应用三质粒瞬转体系,可实现50L-200L-500L-2000L规模生产。目前已经成功完成四十余批次的GMP AAV生产,其中包括多批次500L大规模生产。截至目前共有五款宜明生物提供全程CDMO服务的AAV基因药物IND申请快速获批*
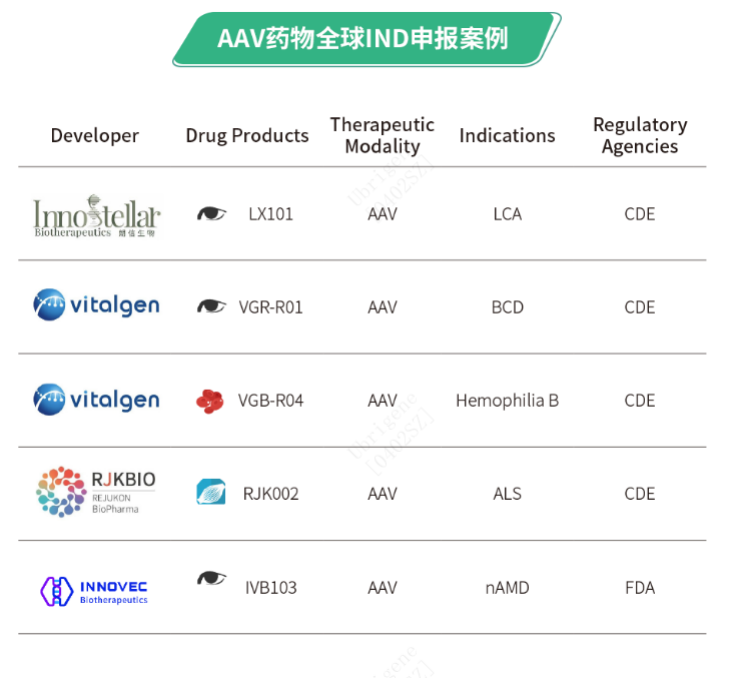
*:五款与宜明细胞合作获批NMPA IND的AAV基因药物分别是天泽云泰的“VGR-R01”和“VGB-R04 ”、朗昇生物的“LX101”、瑞吉康的“RJK002”、因诺惟康的“IVB103”
该平台使用自主驯化的无血清悬浮293XSTM细胞株(已获得国家知识产权局颁发的发明专利证书并完成FDA DMF备案),可以实现高密度培养,大幅度提高AAV产量。高产量可以减轻下游纯化阶段的压力。另外通过对载体以及转染体系的优化,提高了AAV包装效率,减少了空衣壳的产生,从而减轻了下游纯化的负担。
此外,质粒是CGT药物绕不开的起始物料,特别是对于采用“三质粒瞬转体系”生产的AAV载体。但质粒工业化生产同样面临诸多挑战:包括碱裂解、宿主RNA和染色体DNA的清除等问题。尽管大规模的生产可以降低成本,但目前GMP质粒的价格仍高达每克数十万美元。
宜明生物的Ubri-PerfectTM GMP 质粒生产平台可放大、高效且经济,可实现5L-10L-50L-200L规模生产。该工艺在大肠杆菌培养中具有较高的质粒扩增率,每升产量可达0.5~1克。专有的连续流碱性裂解工艺全程可控、高效的两步色谱法极大地降低了成本。
BEV/Sf9系统与可以稳定表达rep的Sf9细胞相结合,可用于灵活的、高滴度的大规模AAV载体生产。该生产体系安全性好, 感染效率高, 生产工艺较之sTT更易放大,生产率更高。但是有报道称BEV体系生产的AAV因发生衣壳蛋白翻译后修饰而降低传染性,因此哺乳动物生产细胞系统仍然是病毒载体生产的更可靠的选择。
稳转包装细胞系稳定持续表达辅助基因rep/cap以及目的基因等载体成分,这项技术无需质粒转染,只需经腺病毒感染后(wtAd5)即可包装出AAV病毒,可直接放大生产规模。但是, 稳转细胞系构建周期长, 且与BEV/Sf9系统一样,在生产过程中需要使用辅助病毒感染,不仅给下游纯化带来负担,也增加了安全隐患。
综上所述,上游的几大生产系统都有各自的优势和挑战,选择“最佳”生产平台其实是在灵活性、可扩展性和质量之间的权衡,这三个标准对于快速开发和商业化安全有效的产品都很重要。开发者要评估总体产品需求、临床试验时间表、目标患者群规模,然后再结合各个平台的风险做出明智的选择。另外关于各大平台工艺的参数对AAV安全性和有效性的影响尚未完全知晓,因此需要在早期明确选择,以规避切换生产平台所导致的各种阻碍。
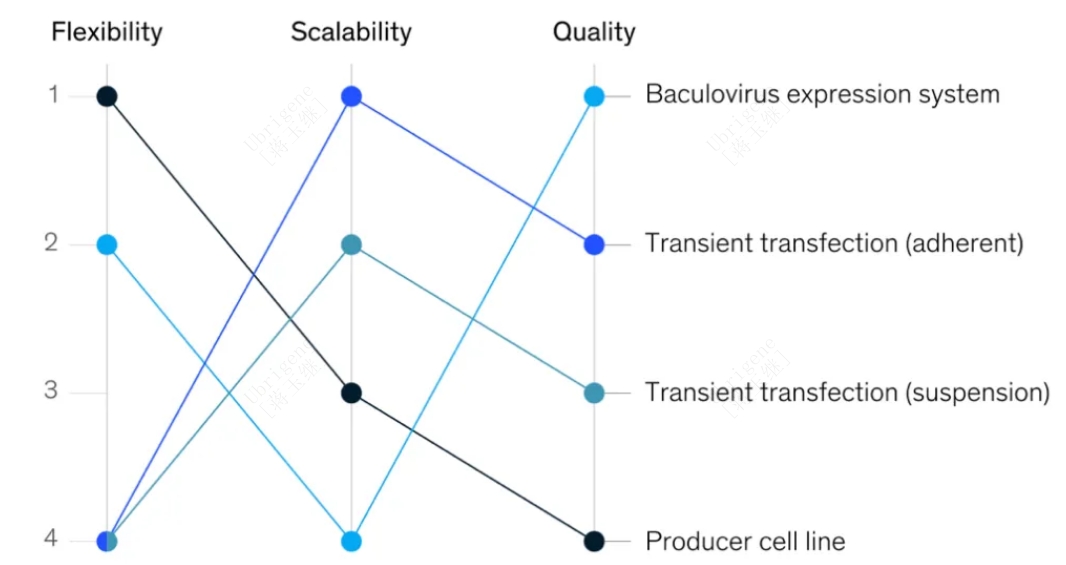
图2:病毒载体三大生产体系灵活性、可扩展性和质量之间的比较
(图片源自https://www.mckinsey.com/industries/life-sciences/our-insights/viral-vector-therapies-at-scale-todays-challenges-and-future-opportunities)
下游生产环节的挑战
AAV下游加工的目的是从上游产物中分离并纯化AAV载体,使最终产品达到需要的纯度。不同上游生产平台产生的杂质相似,包括工艺相关杂质,如宿主相关的蛋白、DNA以及残留的辅助病毒等;产品相关杂质,如空衣壳。由于AAV病毒载体纯化的复杂性,目前尚未建立业内标准化的下游纯化流程。
下游工艺的成败往往受到上游生产的影响,理想的起始原料(高滴度、高活性、低空壳率的AAV)对于下游生产至关重要。但AAV载体上游产量普遍较低,增加了下游捕获和纯化的难度。另外的一个难点是较高杂质水平。其中空衣壳是目前业内最为关注的杂质之一。
在AAV载体组装过程中,除了正确包装的DNA序列的完整衣壳(full capsid),还会出现部分衣壳(partial capsid),和空衣壳(empty capsid)。后两者属于杂质,不仅仅影响产品的纯度,增加最终产品的免疫原性,还会与完整衣壳竞争结合受体,从而抑制完整衣壳的转导,增加总体病毒载量。部分衣壳与空衣壳的存在严重地影响了AAV产品的安全性和有效性,因此监管机构强烈建议在整个生产过程中监控空/完整衣壳比(空壳率)。
氯化铯(CsCl)/碘克沙醇密度梯度离心是最传统的AAV纯化技术方法,但因难以放大和低通量等劣势逐渐被色谱法取代。色谱法通过载体的净电荷、疏水性、对配体的亲和性、大小以及其他性质来分离并纯化载体。这类技术更具可扩展性和成本效益,可并联或串联运行,还可有效去除非定植剂。其中亲和层析(Affinity chromatography,AC)是目前首选的病毒捕获步骤,离子层析(Ion-exchange chromatography,IEC)可以有效的分离空衣壳。
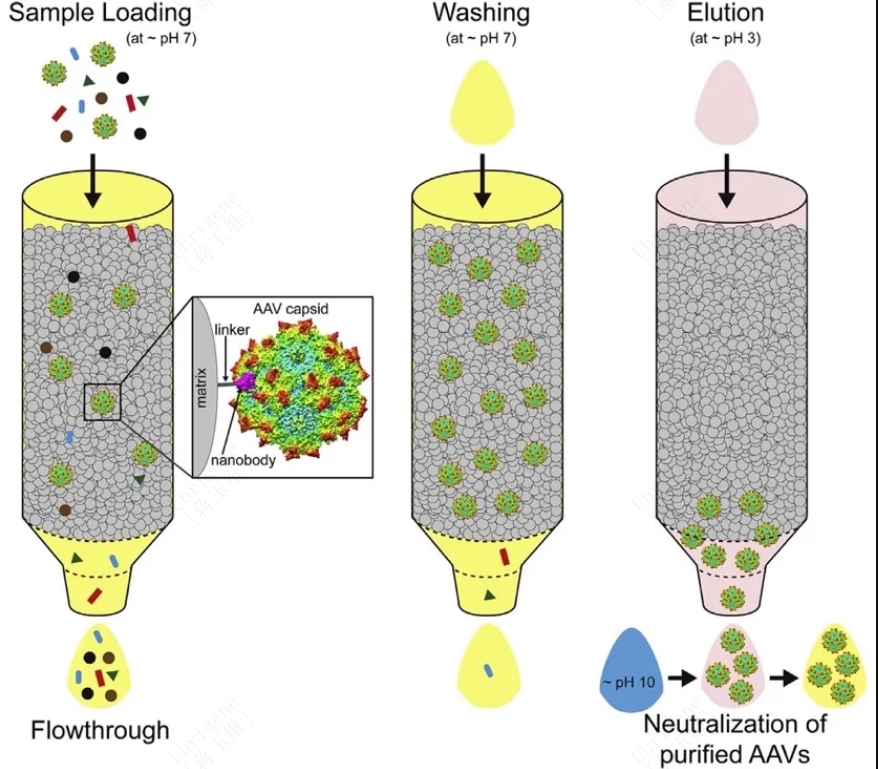
图3:AAV的捕获(亲和层析AAV的纯化),通过AAV与填料的基质上偶联的抗体或纳米体地特异性结合来实现
(源自:https://doi.org/10.1016/j.omtm.2020.10.001)
然而,目前只有一小部分亲和树脂可以与一种或几种AAV病毒血清型特异性结合,如AVB Sepharose可选择性结合AAV 1、2、3和5以及POROSTM CaptureSelect 可选择性结合AAV8、AAV9和AAVX(包括血清型1-9和工程化衣壳)。而且配体设计和制造的高成本也一定程度限制了亲和层析在大规模病毒生产过程中的应用。因此为了能开发出更经济、高效的捕获和纯化AAV的新方法 ,还要更深入地了解病毒载体与不同吸附表面(亲和层析、多模式色谱和离子交换色谱材料)的结合。
离子交换层析是一种通用、经济且高效的大规模AAV纯化技术,利用病毒颗粒表面电荷差异化去除空衣壳(空衣壳PI~6.3,完整衣壳PI~5.9)。离子层析的高分辨率需要复杂的梯度,但稳健的梯度洗脱仍然是一个挑战。为了充分分离所有血清型的载体,人们仍然在探索新型树脂与方法。比如CIMmultusTM PrimaT是一种分离空衣壳的离子交换-氢键多模式色谱柱,为空衣壳和满衣壳的分离提供了一种新的正交选择,其功能等同于离子交换柱,但通常分辨率更高。
在宜明生物,得益于上游293XSTM细胞株的高产量,以及优化转染体系后的高包装效率,叠加对色谱技术的不断开发,下游纯化平台实现了更高的可扩展性和产品一致性。另外,该平台无血清、无动物源性生产原料、无抗生素、无辅助病毒等,减少了外源性杂质的引入,也缓解了下游纯化的压力。可扩展的两步法纯化流程,可用于多种血清型的纯化,包括rAAV2/2、rAAV2/5、rAAV2/8、rAAV2/9,在两步法纯化后实心率近90%。
与监管机构的沟通
世界各地的监管机构都已经认识到AAV疗法的潜力,并致力于为其开发和批准建立更清晰的指导方针。由于AAV基因治疗领域是新兴领域,在大规模生产以及商业化方面经验有限,在不同地区监管要求也可能存在差异。这些差异可能涉及到技术适应性测试、合规审查、申请程序等。除了要满足不同地区监管的要求和规定,开发者在新药多地申报时(中、美、欧等),还可能面临语言障碍、文化差异、专业知识等挑战。
宜明生物作为一家CDMO服务商,我们以客户需求为中心,在不断进行底层技术创新的同时,也为客户在中、美等多地申报提供服务,为新药的商业化节省资金与时间成本。
用于AAV生产的现货辅助质粒系统(DMF 28890)以及无血清悬浮293XS细胞库(DMF 28844)均已完成FDA DMF备案,极大地缩短产品在FDA审查和评估时间。
在中美两地设有申报团队,一站式助力客户完成中美双报项目,目前已有数十例注册申报成功案例。
小结
尽管商业化道路曲折坎坷,但基因疗法是仍然是全球生物医药产业竞争最重要的“新赛道”之一,AAV依旧是一种非常具有吸引力的基因转导方式。随着底层技术不断创新升级,资本的持续青睐,国家与各地政府的有力扶持,层层技术壁垒的打破,病毒载体可实现更好的成本控制,提高AAV药物的可及性,充分发挥发挥CGT的更大潜力,惠及更多的患者。
Ref:
https://doi.org/10.1002/bit.28412
https://doi.org/10.1016/j.coche.2021.100780
https://doi.org/10.1016/j.chroma.2023.464337
https://doi.org/10.1016/j.omtm.2020.10.001
https://www.mckinsey.com/industries/life-sciences/our-insights/viral-vector-therapies-at-scale-todays-challenges-and-future-opportunities

