人类诱导多能干细胞(iPSC)可以扩增并分化为具有治疗作用的特化细胞。作为新型细胞疗法的起始材料,iPSC在再生和个性化医学中已显示出巨大的潜力。然而,实现ipsc衍生疗法的产业化面临着很多挑战,包括如何在制造过程中分析,评估和监测细胞扩增、分化以及最终产品的质量等。尽管一些常见测试方法已经被行业认可并用于iPSC的放行检测(见图一),但是仍然存在问题,如:
1、具体表征方法会因目标细胞治疗适应症以及生产机构而异。据文献报道,一项来自16家iPSC制造机构的调查显示,各机构在参数、测定方法和标准方面存在很大不同。
2、目前对自体iPSC的疗法分析表征方法已经逐渐清晰,但是其衍生疗法和异体iPSC产品的监管指南还在不断发展完善中。
3、已有的表征iPSC库的分析法可能并不足以应对GMP的放行要求。人们应用全基因组测序、微阵列、RNAseq和DNA甲基化等检测方法来表征iPSC库,但这些方法不太适用于常规检测。
4、用于放行的检测方法组合可能还会因为iPSC产品的最终用途以及生产机构的具体情况而更加复杂化。
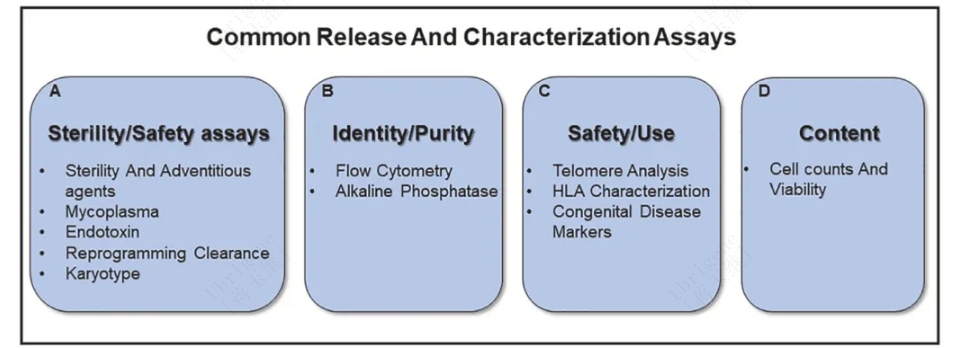
图1|常用放行和表征试验。A) 无菌和安全性的试验,包括无菌、支原体、内毒素、重编程清除和核型试验。B)ID鉴定和纯度检测,包括流式细胞术和碱性磷酸酶检测。C)安全性的检测,包括端粒分析、HLA表征和先天性疾病标志物。D)iPSC库的放行检测包括细胞计数和活力测定。(源自doi.org/10.1016/j.btre.2023.e00784)
笔者将分两期简要介绍iPSC产品的表征方法、效力和安全性的重要分析方法,以及其中的挑战和潜在解决方案。
基于流式细胞术的iPSC鉴定及纯度检测
流式细胞仪的panel设计取决于1)起始材料,2)通过重编程产生的多能干细胞或在扩增过程中建立的多能干细胞,以及3)定向分化的最终细胞治疗产品。
用于起始材料检测:很多的组织可用于制备iPSC,如人类脐带血。用于识别细胞干细胞潜能的常用表面分子包括:CD34(识别造血干细胞和祖细胞)、CD9(白细胞抗原)、CD133(Prominin 1)、CD30(肿瘤坏死因子受体)、CD200 (MRC OX-2抗原)和CD38(环ADP核糖水解酶)等。
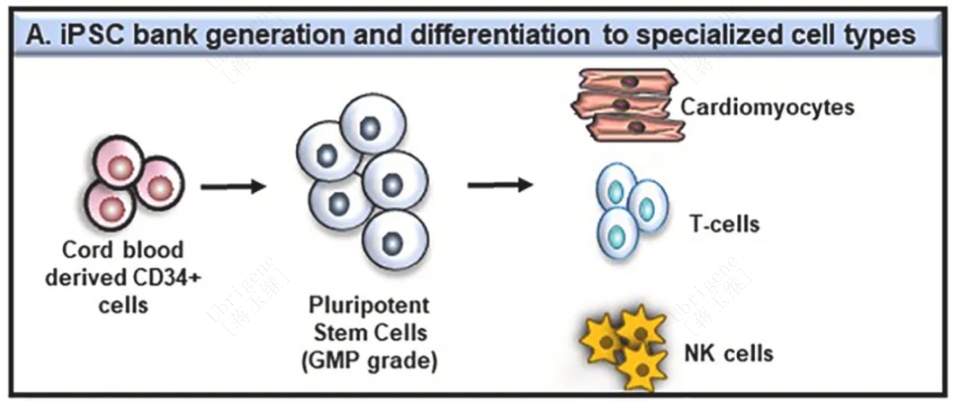
图二| 由脐带血CD34+细胞生成iPSC细胞库分化成心肌细胞、T细胞和NK细胞的示意图
用于通过重编程和扩增产生的多能干细胞检测:在干细胞分化前常检测的多能性标记,包括OCT4, NANOG, SOX2。随着iPSC在分化为具体的细胞类型后,仍可能携带残留的iPSC,而这些残留的iPSC需要在临床应用前识别并清除。目前最常用的识别iPSC/hESC的表面Marker是TRA-1-60、Stage Specific Embryonic Antigen 4 (SSEA-4)和TRA-1-81。其中SSEA-4的表达似乎先于TRA-1-60和TRA-1-80,后者只能在分化后期检测到。
用于定向分化后的最终细胞治疗产品的检测:iPSC可以靶向分化为各种最终细胞,包括有治疗作用的心肌细胞,T细胞,NK细胞和B细胞等(见图二)。在这种情况下,最终细胞药物的表征及其纯度都需要在放行panel中检测。例如,用于鉴定iPSC分化的心肌细胞的流式细胞仪panel,包含成熟的心肌细胞标记物(如c -肌钙蛋白、钙电压门控通道、肌球蛋白轻链和重链以及转录因子GATA-4)。同样,检测T细胞产物的panel通常包含淋巴细胞标记物(如CD3、CD4、CD8和CD56(阴性标记物))。检测NK细胞产物的panel包含CD16 (FcγRIII)、CD57、CD56、NKG2C等标记物。
用于干细胞类(ESC或iPSC)的检测:有研究者还开发了不同的染色panel以确定起始材料的质量,如检测源于脐带血的CD34+细胞在扩增第4天(在重编程成iPSC前)的扩增水平和纯度,以及(重编程和扩增后)iPSC表型特征。
此外,目前多种细胞治疗产品已经建立了最终产物特异性流式细胞仪panel。例如用于胰岛素分泌β细胞的胞质c肽、核蛋白NKX6.1、胰岛素启动因子PDX1和运动神经元和胰腺同源异型盒蛋白1(MNX1)。
细胞计数和活力(CCV)
细胞计数和活力是确定活细胞数量的关键步骤。其中活细胞密度(vialing density)是最终分化细胞产品关键的CCV检测之一。对于iPSC而言,其定向分化的细胞数量也被认为是维持initial feed和分化过程一致性的关键参数。在分化起始、传代、细胞扩增和收获过程中对活细胞的精确测量,有助于全程监控并更准确地评估最后分化细胞的用药量。
但是iPSC在培养过程中易形成较大集落,需要酶、化学或机械分离方法连续传代培养,导致细胞往往有相互重叠,因此人工计数方法很难得到准确数据。为了提高细胞计数的准确性和效率,人们通过调整细胞染色、图像显示参数和细胞形态成功地开发了几种自动化细胞计数器技术,如NucleoCounter®NC-200, Vi-CELL细胞活力分析仪,Cellometer自动细胞计数器。其中,NC-100和NC-200自动细胞计数设备已被证明可用于评估iPSC平台的活细胞数量和细胞活力。自动NucleoCounter NC-200 (Chemometec)使用吖啶橙和碘化丙啶,而Cellometer (Nexcelom)和 Vi-CELL (Beckman Coulter)使用台盼蓝作为活性染料。这些自动化系统可用于给定细胞类型的细胞计数,其中成簇细胞计数方案适用于iPSC计数。
Reprogramming clearance
重编程清除或残留检测需要根据重编程过程定制。例如重编程过程涉及转染的质粒、使用病毒/病毒载体和转座子等残留需要检测。同时还要检测重编程之后残留的“Yamanaka因子”(Oct4、Sox2、Klf4、c-Myc和Lin28)。
EBNA/OriP质粒通常用于重编程,因为它是一种非整合质粒,可以在连续传代之后从细胞中清除。处于安全性考虑以及监管要求,需要一种可靠的检测手段可以量化残余质粒或证明其是否被完全清除。目前检测残留质粒最可靠的方法之一是TaqMan-based qPCR。这一方法具有高度的特异性和敏感性,可以用来检测EBNA和OriP质粒。然而,考虑到EBN/OriP区域只是一个片段,该区域之外的残留片段可能检测不到。
随着技术的不断进步,更灵敏的检测方法也不断脱颖而出,例如digital droplet PCR(ddPCR),下一代测序(NGS) 等。ddPCR比qPCR方法更灵敏度,能够对样品中的核酸进行绝对定量。一个样品可以被分成约20,000 个液滴,在每个单独的液滴中模板分子进行 PCR 扩增。PCR后,分析或读取每个液滴以确定原始样品中 PCR 阳性液滴的比例,并通过统计分析这些数据以确定原始样品中的目标 DNA 模板浓度。然而,与qPCR一样,ddPCR仍然有可能无法检测到残存在细胞中的质粒片段。这一风险可以通过设计多个引物来降低,这样可以检测到质粒的多个区域,以确保没有剩余的质粒片段。相比较之下,NGS可以对样品中的所有DNA或RNA进行测序,而不局限于EBNA/OriP片段,是检测残余重编程质粒的宝贵工具。然而,全基因组测序仍然相当昂贵,目前市场上可用于商业用途的平台有Illuminia MiSEQ和ABI SOLiD平台。
主细胞库病毒检测
作为主细胞库(MCB)和以及用于临床应用的同种异体细胞产品都需要检测病毒污染物,包括逆转录病毒、腺相关病毒以及牛、猪和人病毒等等。
以逆转录病毒为例,现在较为常用的检测逆转录酶活性的方法是产物增强性逆转录反应(PERT)。PERT方法是在以RNA为模板的PCR体系中,加入待测样品,如样品中含有逆转录病毒表达的逆转录酶,则该PCR体系则可以扩增,由此证明样品是否有逆转录病毒污染。 然而,有文献表明,样品中过量的DNA聚合酶活性会干扰并提高检测的背景信号,这可能导致错误检测结果。目前有两种常用的基于PERT的细胞库逆转录病毒检测方法:QPERT和FPERT。
QPERT(定量PCR增强逆转录酶),将所检测到的测试样品活性与标准曲线进行比较,是一种定量检测逆转录酶的一种方法。QPERT可常规用于评估整个生产过程中逆转录病毒水平,RT活性增加意味着污染事件发生,由于是全程监测,分析初期可能的出现假阳性也并不需要过于关注。
FPERT(荧光PCR-增强逆转录酶)检测,是定性检测逆转录酶的一种方法。该检测旨在评估生物过程中大规模收获以及最终产品的RT活性(从而检测是否存在逆转录病毒污染)。一般的行业标准是以FPERT检测结果放行,以QPERT检测监控生产过程表示在制品。

